「間質性肺疾患に合併した気胸症例における治療方針と
治療成績の前向きリアルワールドデータ調査」についてのご説明
患者さんへ研究協力のお願い
研究課題
「間質性肺疾患に合併した気胸症例における治療方針と
治療成績の前向きリアルワールドデータ調査」についてのご説明
当院では、最新の(最善の)医療を患者さまに提供するとともに、より良い治療法や診断法などを開発するための臨床研究を行っています。患者さまに参加いただいて、治療方法や診断方法が有効であるか安全であるかを調べることを臨床研究といいます。
この説明文書は、患者さまに臨床研究への参加をお願いするにあたり、研究担当医師の説明をおぎない、患者さまの理解を助けるために用意されたものです。この説明文書をよくお読みいただくとともに、よく理解していただいて、あなたが臨床研究に参加しても良いかどうかを十分に考えて判断してください。わかりにくいことや不安な点がある場合は遠慮なく研究担当医師にお聞きください。なお、この臨床研究は国立病院機構臨床研究中央倫理審査委員会(以下、中央倫理審査委員会といいます。)の審査を受け、試験方法の科学性、倫理性や、患者さまの人権が守られていることが確認され、当院の院長の許可も受けています。
以下の説明をよくお読みいただき、ご不明な点は研究担当医師にご確認いただいた上で、本臨床研究への参加に同意するかどうかを、ご自身の意思で決めてください。同意される場合には、この説明文書の最後に付いている同意書に署名し、日付を記入して研究担当医師に渡してください。また、本臨床研究に参加されなくても、あなたが不利益を被ることは一切ありません。
間質性肺疾患患者さんの3.6~11.4%に続発性気胸が発生すると報告されています。これは原病の進行により肺胞が破壊され、胸膜直下のブラ(肺の弱い部位)が破綻するためとされています。このような間質性肺疾患に合併した気胸に対する治療は現在までのところ治療ガイドラインもなく、ドレナージに加えて胸膜癒着療法や外科的治療など様々な治療が施設毎に行われているのが実情です。
いずれの治療方針もそれぞれの有効性と安全性に関しては明確なデータはなく、さらに治療効果が不十分な場合、集学的な治療が必要とされます。このように治療方針が確立されていない間質性肺疾患に合併した気胸における治療の現状を把握し、その有効性、安全性を検討することが急務と考え、国立病院機構に属する病院が多施設共同で間質性肺疾患に合併した気胸患者さんの治療経過についての前向き登録によるデータベース事業を行うことになりました。
- ◆ 本研究のタイトルにある「リアルワールドデータ」とは・・・
- 一般的な医学臨床研究において、薬や治療の効果を評価する際に対象となる患者さんには、その背景(性別や年齢、全身状態、併存疾患など)に多くの制限を設けてそれをクリアしなければならない規定があります。言い換えれば多くの場合、その制限をクリアした条件の良い患者さんを選択して研究を行っていることになります。その方法では、様々な背景を有する患者さんに対応しなければならない臨床の現場で、実際に行われる治療に研究結果が適用できない場合も少なくありません。それに対し患者さんを選択する際、背景に制限をなるべく設けず、日常の臨床現場で実際に行われている治療についてのデータを集積することを「リアルワールドデータ」と呼びます。本研究は「リアルワールドデータ」を集積します。
本研究の目的は、間質性肺疾患に合併した気胸患者さんを前向きに登録して、治療法の選択やその結果についてデータベースを構築し、治療成績を検証し、標準治療の確立のための基礎データを構築することです。さらに、構築されたデータベースをもとに臨床研究を行い国内外に情報発信する予定です。
カルテに記載されている一般的な診療情報を全国規模のデータベースに登録します。本研究の対象となる患者さまは、以下の条件をすべて満たす方となります。
- (1)研究に参加していただける方の主な条件
- ①間質性肺疾患に合併した気胸に対する診療(ドレナージ、手術療法、胸膜癒着療法、その他の治療、経過観察のみも含む)を行われた20歳以上の患者さん
- ②本研究参加にあたり十分な説明を受けた後、理解の上、患者本人の自由意思による文書同意が得られた患者さん
また、この臨床研究にご参加いただけない患者さんの基準は、以下の通りとなります。ひとつでもあてはまると、研究に参加することはできません。
- (2)研究に参加していただけない方の主な条件
- ①間質性肺疾患を含めて、30日程度の生命予後が厳しいと判断される疾患を有する場合
- ②重篤な感染症を合併している患者
- ③肺切除術後1か月以内の患者(術後肺漏を除外するため)
- ④研究責任者、研究分担者が本研究の参加について適切でないと判断した場合
- (3)スケジュール
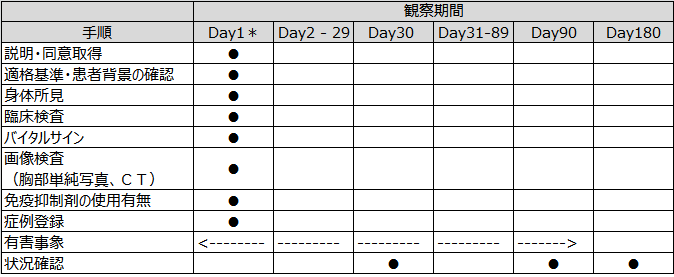 Day1*:登録医療機関で気胸の診断のもと経過観察(ドレナージ非施行)もしくは治療(ドレナージ)を開始した日(通常は初診日)。身体所見・臨床検査・画像検査等は直近のもの(1週間以内のデータ)を登録可能とする。
Day1*:登録医療機関で気胸の診断のもと経過観察(ドレナージ非施行)もしくは治療(ドレナージ)を開始した日(通常は初診日)。身体所見・臨床検査・画像検査等は直近のもの(1週間以内のデータ)を登録可能とする。
患者背景(年齢、性別、既往歴、喫煙歴など)
身体所見(身長、体重など)
臨床検査
末梢血所見(白血球数、ヘモグロビン、ヘマトクリット、血小板数)
生化学所見(総蛋白、アルブミン、LDH、CRP、KL6、SP-A、SP-D、PaO2、PaCO2)
バイタルサイン(血圧、脈拍、SpO2)
画像検査(胸部単純写真およびCTにて気胸ならびに間質性疾患の評価)
免疫抑制剤の使用有無(ステロイドを含む免疫抑制剤内服状況の確認)
有害事象(入院治療期間中における気胸の再発や間質性肺疾患の急性増悪を含めた合併症発生状況)
状況確認(ドレナージ後の治癒/非治癒、ドレナージ非治癒例に対して選択された2次治療法:治癒/非治癒、3次治療法:治癒/非治癒、4次治療法:治癒/非治癒、生存・再発の確認)
本研究に参加された場合の観察期間は、治療後180日までです。
研究全体の予定期間は、中央倫理審査委員会承認後から3年です。
参加人数は、全国の施設で約200人を予定しています。
この研究は通常の診断や治療、検査を行い、その中で得られた診療情報を収集する研究であり、研究に参加することによるあなたへの直接の利益や不利益はありませんが、より良い治療法や診断法などの開発に貢献することができます。本研究の結果があなたに有益な情報をもたらす可能性は低いと考えられますが、本研究の成果は医学の発展に寄与するもので、将来あなたと同じような病気に苦しむ方々の診断や予防、治療などがより効果的に行われるようになることが期待されます。
この研究は、通常の診断や治療、検査を行い、その中で得られた診療情報を収集する研究であり、研究に参加することにより副作用などの健康被害が生じることはありません。もし、研究の期間中にあなたに副作用などの健康被害が生じた場合には、通常の診療と同様に医師が適切な診察と治療を行います。
この研究は、患者さまが通常の診療(治療や検査等)を行う中で得られた診療の情報を収集する研究であり、研究に参加しなかった場合でも、治療方法の変更はありません。
この研究への参加に対して同意するかどうかは、あなたの自由です。同意しない場合でも、あなたの病気の治療を続ける上で不利な扱いを受けることは決してありません。この研究に参加することに同意した後でも、「研究への参加を取りやめたい」と思ったときには、たとえ研究期間中でもいつでも自由に同意を取りやめること(同意撤回(どういてっかい)といいます。)ができます。また、最後まで研究に参加しなくても不利な扱いを受けることは決してありません。
あなたに研究参加の同意をいただいた後でも、あなたの身体の状態やその他の理由や研究担当医師の判断により、研究へ参加いただけなかったり、研究を中止することがありますので、ご了承ください。
なお、途中で研究の参加をやめられる場合でも、中止までに得られた情報や、中止後の安全性確認の結果については、研究に使用させていただきます。情報の使用についても中止を希望される場合は、その旨を研究担当医師までご連絡ください。
本研究では、患者さんの半年後の状態を調べます。定期的な受診をされていない場合など、必要に応じて電話やお手紙で確認することがありますので、電話番号や住所が変更となった場合は担当者までご連絡ください。
この研究に参加されている間に、あなたの研究参加の意思に影響するような新たな情報を入手した場合には、その都度その内容をお知らせします。その場合には、研究の参加を継続されるかどうか、再度お決め下さい。研究の参加を継続することも、中止することもできます。
研究終了後も、それまでと同様にあなたの状態に合った治療を行います。
この臨床研究で使用する薬の費用や検査の費用は、通常に診療を受ける場合と同じように、健康保険を用いて自己負担分をお支払いいただくことになります。なお、この臨床研究でかかる費用は、臨床研究に参加しないで同じ治療を受けた場合にかかる費用と同じです。
本研究は国立病院機構運営費交付金研究費により実施しています。本研究では関連企業等に対する経済的利益は生じません。
この臨床研究は、国立病院機構の研究ネットワークグループのひとつである呼吸器疾患研究グループが主体となって行っています。当院も呼吸器疾患研究グループに参加しています。
この研究に参加していただいても、謝礼は発生しません。
利益相反とは研究成果に影響する可能性のある利害関係をいいます。これには金銭及び人的、物理的関係を含みます。
本研究を行うにあたり、わたしたちは企業・財団等からの援助を受けておりません。そのため、特定の企業等の利益となるように、故意にあなたの治療方針を変えたり、研究の方法を変更するようなことはありません。
この研究で得られた結果は、あなたの個人情報(名前や住所、電話番号など)に係わる情報を切り離してから、他の病院から集められた結果とともにまとめられ、学会や医学雑誌などに発表されることもあります。ただし、いずれの場合にも、あなたの個人情報が公表されることは一切ありません。
集められた医療情報は主な研究成果を報告してから少なくとも5年間が経過するまで研究事務局内の施錠可能な保管庫にて保管いたします。また、研究のために集めた情報は、当院の研究責任者が責任をもって保管し、研究終了後に個人を識別できる情報を取り除いた上で廃棄いたします。
この研究により得られた結果が、特許権等の知的財産を生み出す可能性がありますが、その場合の知的財産権は研究者もしくは所属する研究機関および国立病院機構に帰属します。
この研究の概要は、研究を開始する前に公開データベースである臨床試験登録システム(UMIN-CTR)に登録し、 研究計画書の変更及び研究の進み具合に応じて登録内容を更新していきます。研究を終了したときは、研究の結果を登録します。また、より詳細な研究の計画、 研究の方法についてお知りになりたいときには、研究担当医師までご連絡ください。この研究に参加している他の方の個人情報や、研究の知的財産等に支障がない範囲で研究計画書の閲覧や説明をいたします。
この研究の関するについて、わからないことや、聞きたいこと、また何か心配なことがありましたら、いつでも遠慮なく研究担当医師におたずねください。
また、病気やけがなどで他の治療を受けるときも、研究担当医師までご連絡ください。
【実施医療機関の研究責任者の連絡先】
国立病院機構松江医療センター
〒690-8556 松江市上乃木5-8-31
TEL:0852-21-6131
研究責任者:呼吸器外科 診療部長 荒木 邦夫
研究分担者:呼吸器外科 医長 目次 裕之
【研究代表者(臨床研究全体の責任者)】
〒739-0041 広島県東広島市西条町寺家513
TEL:082-423-2176
職名:国立病院機構 東広島医療センター 呼吸器外科 部長
氏名:原田 洋明